Jumlah panas, kecepatan penyaluran panas, dan flux panas semua dinotasikan dengan perbedaan permutasi huruf Q. Mereka biasanya diganti dalam konteks yang berbeda.
Jumlah panas dinotasikan sebagai Q, dan diukur dalam joule dalam satuan SI.
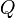 adalah banyaknya kalor (jumlah panas) dalam joule
adalah banyaknya kalor (jumlah panas) dalam joule adalah massa benda dalam kg
adalah massa benda dalam kg adalah kalor jenis dalam joule/kg °C, dan
adalah kalor jenis dalam joule/kg °C, dan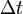 adalah besarnya perubahan suhu dalam °C.
adalah besarnya perubahan suhu dalam °C.
Flux panas didefinisikan sebagai jumlah panas per satuan waktu per luas area, dan dinotasikan q, dan diukur dalam watt per meter2. Juga biasanya dinotasikan sebagai Q″ atau q″ atau
[sunting] Perubahan suhu
Jumlah energi panas, ΔQ, dibutuhkan untuk menggantu suhu suatu material dari suhu awal, T0, ke suhu akhir, Tf tergantung dari kapasitas panas bahan tersebut menurut hubungan:- Cp = mcs
- Cp = ncn.
Kapasitas panas molar dapat "dimodifikasi" bila perubahan suhu terjadi pada volume tetap atau tekanan tetap. Bila tidak, menggunakan hukum pertama termodinamika dikombinasikan dengan persamaan yang menghubungkan energi internal gas tersebut terhadap suhunya.




No comments:
Post a Comment